Le cellule tumorali non solo devastano il corpo, ma “competono” anche tra loro per proliferare all’interno del tumore. Questa competizione potrebbe essere modellizzata tramite la teoria dei giochi: così facendo, il trattamento farmacologico del cancro – che ha indubbie conseguenze sul corpo del paziente – potrebbe essere somministrato in modo diverso, massimizzando l’efficacia e minimizzando gli effetti collaterali.
Come si legge nell’articolo pubblicato sulla rivista “Proceedings of the Royal Society B: Biological Sciences”, un gruppo di matematici della Cornell University, in collaborazione con oncologi della Cleveland Clinic, ha usato la teoria evolutiva dei giochi per modellizzare le interazioni di tre sottopopolazioni di cellule tumorali polmonari che si differenziano per la loro relazione con l’ossigeno: cellule glicolitiche (GLY), sovrapproduttori vascolari (VOP) e disertori (DEF).
[Originariamente apparso il 10 maggio 2020]
Nel modello, le cellule GLY sono anaerobiche (cioè non richiedono ossigeno), le cellule VOP e DEF usano entrambe l’ossigeno, ma solo le cellule VOP sono disposte a spendere energia extra per produrre una proteina che migliorerà la vascolarizzazione e porterà più ossigeno alle cellule.
Alex Vladimirsky, tra gli autori dello studio, paragona la loro competizione a una sorta di morra cinese giocata da un milione di persone una contro l’altra. Se la maggior parte dei partecipanti sceglie il sasso, un numero maggiore di giocatori sarà tentato di giocare carta. Con l’aumentare del numero di persone che giocano carta, sempre meno persone sceglieranno sasso e quindi molte altre passeranno alle forbici. Con l’aumentare della popolarità delle forbici, il sasso diventerà di nuovo un’opzione attraente, e così via. “Quindi hai tre popolazioni, tre strategie competitive, che subiscono oscillazioni cicliche”, spiega Vladimirsky, che dirige il Center for Applied Mathematics, “senza una terapia farmacologica, i tre sottotipi di cellule tumorali possono seguire traiettorie oscillanti simili. La somministrazione di farmaci può essere vista come una modifica temporanea delle regole del gioco”.
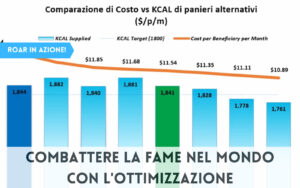
Allora, ci si chiede subito come e quando modificare le regole per raggiungere i nostri obiettivi a un costo minimo, sia in termini di tempo di recupero che di quantità totale di farmaci somministrati al paziente. “Il nostro principale contributo – continua il matematico – è di calcolare in che modo ottimizzare in modo adattativo questi periodi di trattamento farmacologico. Abbiamo sostanzialmente sviluppato una funzione che mostra quando somministrare farmaci in base all’attuale rapporto di diversi sottotipi di cancro”.
Nella pratica clinica corrente, i malati di cancro ricevono solitamente la chemioterapia alla massima dose che il loro corpo può tollerare in modo sicuro, e gli effetti collaterali possono essere gravi. Inoltre, un regime di trattamento così continuo porta spesso le cellule tumorali sopravvissute a sviluppare resistenza ai farmaci, rendendo più difficile un’ulteriore terapia. Il nuovo studio mostra che un’applicazione “adattativa” tempestiva potrebbe potenzialmente portare al recupero di un paziente con una quantità notevolmente ridotta di farmaci.
Ma Vladimirsky avverte che, come spesso accade nella modellistica matematica, la realtà è molto meno netta della teoria, le interazioni biologiche sono complicate, spesso casuali, e possono variare da paziente a paziente. “Il nostro approccio di ottimizzazione e gli esperimenti computazionali erano tutti basati su un particolare modello semplificato di evoluzione del cancro. In linea di principio, le stesse idee dovrebbero essere applicabili anche a modelli molto più dettagliati e persino specifici per il paziente, ma siamo ancora lontani da un risultato di questo tipo. Consideriamo questa ricerca come un primo passo necessario sulla strada per l’uso pratico di una terapia farmacologica adattativa e personalizzata. I nostri risultati sono un valido argomento per incorporare l’ottimizzazione della tempistica nel protocollo delle future sperimentazioni cliniche”.